产品合规
备案/注册/咨询/培训
前 言
化妆品的安全评估作为产品合规的关键技术资料,也是难点的资料,自化妆品新规实施以来,都是行业特别关注的热点。完整版安全评估,在实操的角度,意味着评估方式要求更高更细,还有新的检测项目。在整体的角度,需要在广度和深度上更全面地考虑整个产品,包括原料选择、配方搭建、以及包装包材。综普技术团队基于多年的法规研究和理解,将开展一系列的介绍,希望能帮到行业朋友们。
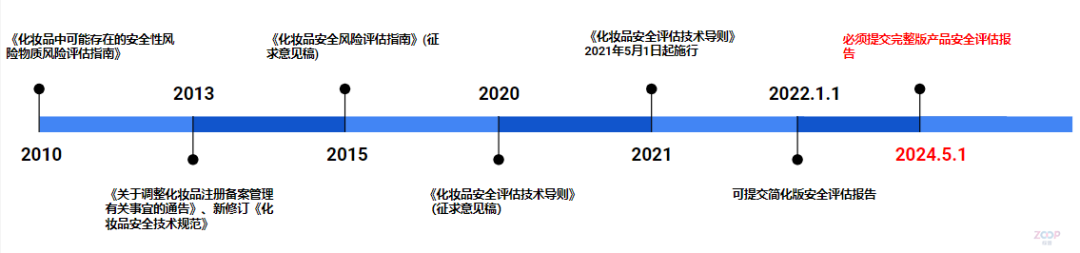
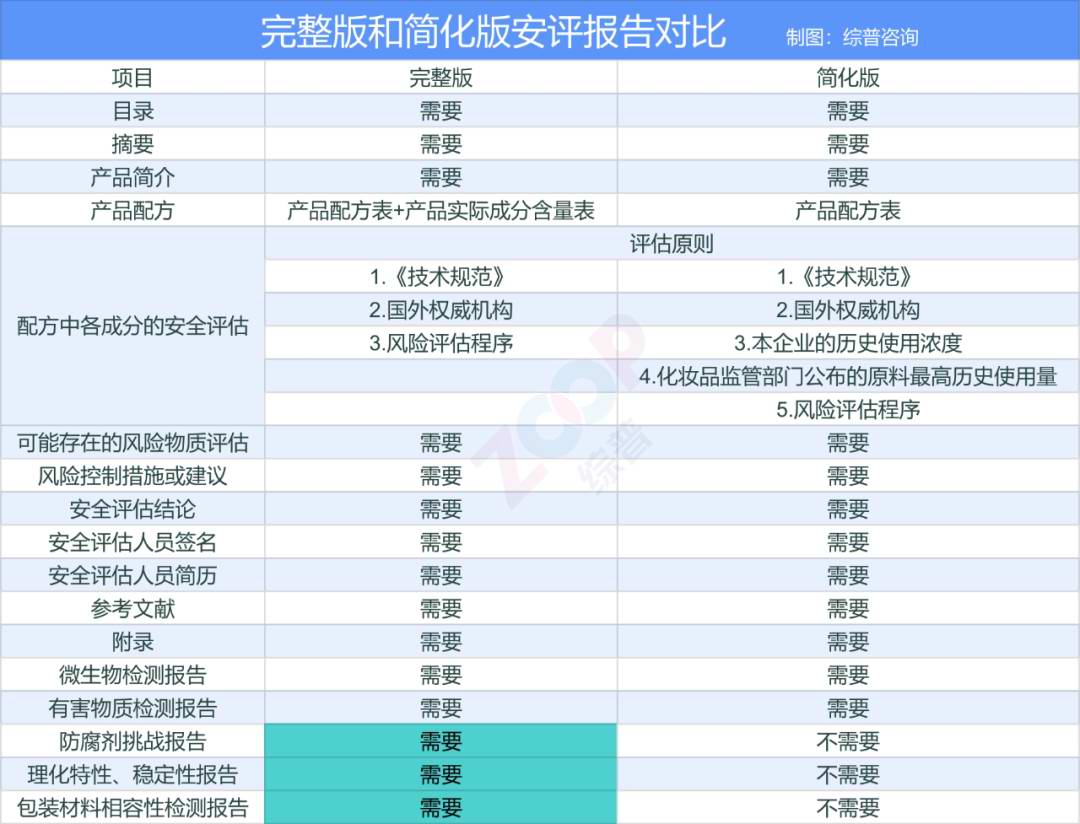
化妆品安评法规发展 化妆品安评的法规发展从2010年推出的《化妆品中可能存在的安全性风险物质风险评估指南》开始,先后经历了2013年的《关于调整化妆品注册备案管理有关事宜的通告》、2015年的《化妆品安全风险评估指南》(征求意见稿)、新修订《化妆品安全技术规范》,再到2020年的《化妆品安全评估技术导则》(征求意见稿)与21年的正式稿,最后到明年的五月开始提交完整版安评。这一发展过程表明官方越来越重视化妆品安全,对化妆品安全评估监管力度愈发严格。 化妆品安评法规发展时间线 原料安全性评估方式 化妆品的安全性由原料安全性、风险物质安全性、产品卫生质量安全性和上市后安全性构成,其中原料和风险物质的安全是化妆品安全的基础和难点。对原料的评估不仅是针对原料本身,还需要对原料可能带入的风险物质进行评估和某些原料间存在相互作用产生的潜在安全风险进行评估。 原料安全性的评估有两种方式,一种是对比式,即将配方中的原料浓度与国外法规中规定的安全限值或者已上市的相同使用方法产品中的浓度进行比较,低于安全限制或者历史使用浓度的,可以评估为安全;另一种为计算式,根据《技术导则》规定的评估程序,利用相关试验和统计数据,用计算的方式,进行风险特征描述。一般情况下,第二种方式更加严谨、科学,但相对费时费力。两种方式可以结合使用,从便捷性角度,可优先选择第一种方式,在个别原料缺少数据或者资料时,用第二种方式作补充。 常见权威机构和数据库 2024年5月1日起,递交的完整版安全评估报告增加了配方防腐剂挑战测试报告、产品理化特性/稳定性检测报告以及产品与包装材料的相容性评估报告,且评估报告不可再使用“化妆品监管部门公布的原料最高历史使用量”和“本企业的历史使用浓度”作为评估的证据,可采取的证据类型《化妆品安全技术规范》和各种国际权威化妆品安全评估机构公布的安全限量或结论,常见的权威机构和数据库有欧盟消费者安全科学委员会(SCCS)、美国化妆品成分审查委员会(CIR)、澳大利亚国家工业化学品申报评估署(NICNAS)、WHO下属食品添加剂相关数据库、EFSA评估的食品相关物质的健康与环境毒理学数据以及美国食品药物管理局FDA一般认为安全物质数据库。其中用得最多的就是化妆品成分审查委员会(Cosmetic Ingredient Review),CIR应该算是所有可用的权威机构结论中数据最全,最好用的一个数据库,如果CIR没有数据,就只能走毒理评估的途径。 毒理评估途径 毒理评估途径包括四个步骤:危害识别,剂量反应评估关系,暴露评估,风险特征描述。 危害识别是指根据产品的使用方法、暴露途径等,确认相关的健康危害效应。 剂量反应评估关系对于有阈值的毒性效应可通过未观察到有害作用的计量(NOAEL)和未观察到有害作用的最低水平(LOAEL)进行观察,对于无阈值的致癌效应,用25%的实验动物的某部位有发生肿瘤的剂量(T25)或BMD来确定,它们可以通过两年的致癌性啮齿动物生物测定(在大鼠或小鼠中)获得;对于具有致敏风险的原料和/或风险物质,还需通过预期无诱导致敏剂量(NESIL)来评估其致敏性。 暴露评估指通过对化妆品原料和/或风险物质暴露于人体的部位、浓度、频率以及持续时间等的评估,确定其暴露水平。暴露评估依赖于特定产品及特定使用方法。 风险特征描述指化妆品原料和/或风险物质对人体健康造成损害的可能性和损害程度的描述。可通过计算安全边际值、终生致癌风险(LCR)、可接受暴露水平与实际暴露量的比较分别对化妆品原料和/或风险物质对人体引起有阈值毒性效应、无阈值致癌效应和致敏效应进行描述。 其中危害识别阶段,就是收集毒理数据的阶段。可以是在各种毒理数据库中检索,也可以做毒理试验。化妆品成分的一般毒理学研究包括急性毒性(如经口毒性)、皮肤吸收(如全身暴露)、皮肤刺激(如腐蚀性/刺激性)、黏膜刺激(如眼刺激)、皮肤致敏(如IV型接触过敏)、亚慢性毒性(如大鼠90天经口毒性、重复剂量毒性)、致突变性/遗传毒性(如DNA损伤)、光毒性和光致突变性(如与阳光的联合毒性)、人体数据(如真实人体情况下的毒性证据)、毒代动力学(如全身暴露量)、ADME(即吸收、分布、代谢、排泄)、致畸性和生殖毒性(如对后代和生殖参数的影响)和致癌性等。 毒理评估途径 豁免系统毒性 是否所有原料都需要走毒理评估途径,提供系统毒性报告呢?答案是否定的。如果存在以下几种情况,可以豁免系统毒性的毒理报告: 1、原料的每日允许摄入量(ADI)、每日耐受剂量(TDI)、参考剂量(RFD)符合世界卫生组织(WHO)、联合国粮农组织(FAO)等已公布的安全限量和结论; 2、被美国食品药品管理局列入Generally Recognized As Safe(一般认为安全物质)名单的物质; 3、无透皮吸收化合物; 4、具有悠久的可食用历史的原料。 对于可食用的原料,如来源于可食用提取部位的提取物在提取工艺上不涉及生物化学或化学反应、原有食物成分结构未发生改变的,在充分证明有安全食用历史的基础上,则该提取物可参考可食用植物部位的安全食用历史评估,可以在证明有安全食用历史的基础上对该提取物的系统毒性进行豁免。相关证据可来源于: 1.取得我国相关监督管理部门食品安全认证或其他相应资质的食品用原料。《中国食物成分表》、《中国居民膳食指南》(2022年版)、国家监管部门发布的函、公告。 2.经国外相关监督管理部门、技术机构或其他权威机构发布的可安全食用的原料。欧盟新食品清单、澳新食品法典第25号清单“允许的新食品原料”、美国FDA GRAS“一般认为安全物质”。 缺少系统毒理学数据的评估思路 毒理数据收集这快,我们面临的挑战是巨大的,当缺少现有毒理数据时,特别是中国特色的植物提取物,是否每个原料都需要全部毒理端点都做完,是否可以参考新原料的情形来选择毒理学端点,我们是否可以用TTC的方式来进行? 目前缺乏毒理学研究数据的评估思路主要有四种,分别是聚合物评估思路、交叉参照评估思路、可食用原料评估思路、TTC评估思路。 聚合物的评估是指对于化学合成的由一种或一种以上结构单元,通过共价键链接,平均相对分子质量大于 1000 道尔顿,且相对分子质量小于 1000 道尔顿的低聚体含量少于 10%,结构和性质稳定的聚合物(具有较高生物活性的原料除外),可不考虑透皮吸收,从而豁免系统毒性数据收集。 交叉参照是一种替代方法,通过使用另一种结构/作用机制相似的物质(源化学物质)来填补某一物质(目标化学物质)的(在某一特定终点)数据缺失。交叉参照的目标是提供证据,表明源化学物质的数据可以用于目标化学物质的风险评估。 TTC是当化学物质的人体暴露剂量低于某个阈值水平时,该化学品对人体健康造成负面影响的可能性很低,无需进行毒理学关注。TTC根据Cramer决策树提出的33个问题,对化合物进行毒性分类,共分为三类,其中Class Ⅲ毒性最大,Class Ⅱ毒性居中,Class Ⅰ毒性最小,每一类的TTC阈值不同。 具有悠久食用历史原料的评估是指对于具有悠久食用历史的原料,对有关资料进行分析后,可以考虑豁免系统毒性数据收集。 经过安全评估,除了得到评估结论外,还有一个重要成果——风险控制措施或建议。这是根据评估得到的风险交流信息,以告知消费者必要的产品使用、存放注意事项。 风险控制措施或建议应标注在产品标签上。化妆品标签上的使用方法应与安全评估报告中的相关内容一致,在开展安全评估时,应按照产品标签标注的使用方法评估,因为使用方法与产品的暴露量、暴露部位等直接相关,将直接影响安全评估结果。 结语 除了做毒理试验,监管部门是否会提供更多的毒理学方法来指导评估的工作,以缩小我们的时间成本和检测成本,这目前也是模糊的。 打铁还需自身硬, 无须扬鞭自奋蹄。政策的实施终会落地,不管细则如何唯有积极应对。行业相关的专业培训、会议分享都很多,大家继续保持深入研究和探讨,借助专业的人才,专业的团队,共同打磨安评方案,使其更为完善。让我们在新的一年里,对合规问题拥有更清晰的思路,以专业的态度迎接挑战!