产品合规
备案/注册/咨询/培训
GB 9706.1-2020《医用电气设备 第1部分:基本安全和基本性能的通用要求》已于2020年4月9日发布,自2023年5月1日起实施,新标准的实施对我国有源医疗器械质量安全水平的整体提升具有重要意义。 |
那么,对于在GB 9706.1-2020及配套并列标准、专用标准(以下简称新版GB 9706系列标准)实施之日前已注册的产品,首次注册和延续注册如何执行?
◇ 首次注册或备案的情况:
对于在新标准实施之日前首次申请医疗器械注册或办理备案的产品,产品已经提交了旧标准要求的检验报告,可按原标准要求审评审批,但建议和鼓励企业在发补阶段补充新标准对应的检验报告。
对于在新标准实施之日后首次申请医疗器械注册或办理备案的产品,应当提交符合新标准要求的检验报告,取得注册证或办理备案后,方可上市。
◇ 延续注册的情况:
对于无适用专用标准的产品,2023年5月1日前申请的延续注册申请,可按原标准要求审评审批;2023年5月1日起申请的,应当按新版GB 9706系列标准要求审评审批。对于产品有适用的专用标准的,如专用标准发布公告规定的实施日期为2024年5月1日,则2024年5月1日前申请的延续注册申请,可按原标准要求审评审批;2024年5月1日起申请的,应当按新版GB 9706系列标准要求审评审批。
那么,针对法规的要求,当注册人未在2023年5月1日前提交注册申请的,应该做好对GB9706.1-2020标准的解读工作,学习新版标准的主要变化,针对产品中不符合新标要求的项目进行必要的设计的变更,对产品进行升级、迭代应用,促进医用电气设备安全性、可用性的提升。
下面整理出了GB 9706.1-2020标准的主要变化以及针对重点变化的解析。
GB 9706.1-2020标准的主要变化
一、引入了基本性能的概念和风险管理的内容。
二、适用范围增加了行动不方便的人使用的设备和非医疗监护使用的设备。
三、对患者和操作者采取不同的防护方式。
四、引入了接触电流和总患者漏电流的概念。
五、对应用部分的温升容许值放宽,引入接触时间,不同的接触时间要求的容许值不一致。
六、增加YY 0708的内容,在GB 9706.1-2020标准中单列为14章。
七、在16章中增加了GB 9706.15的内容,即医用电气设备和医用电气系统的要求。
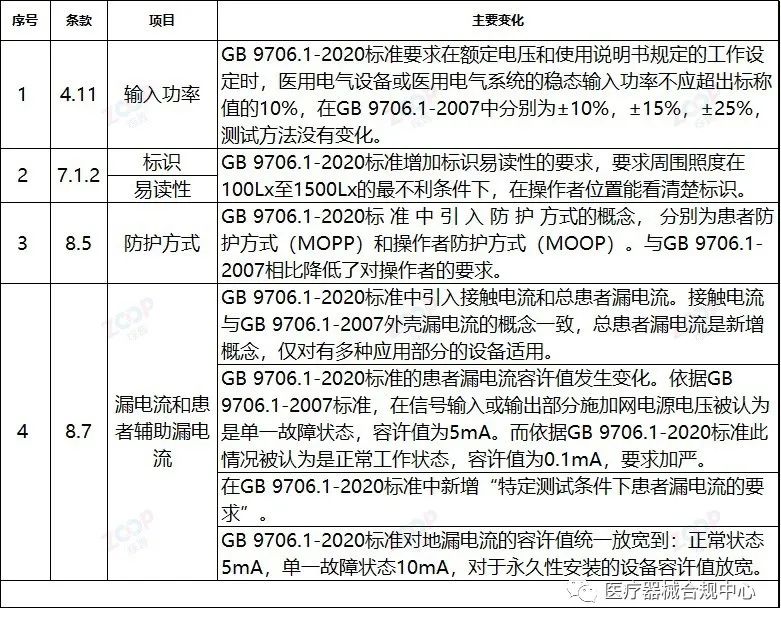
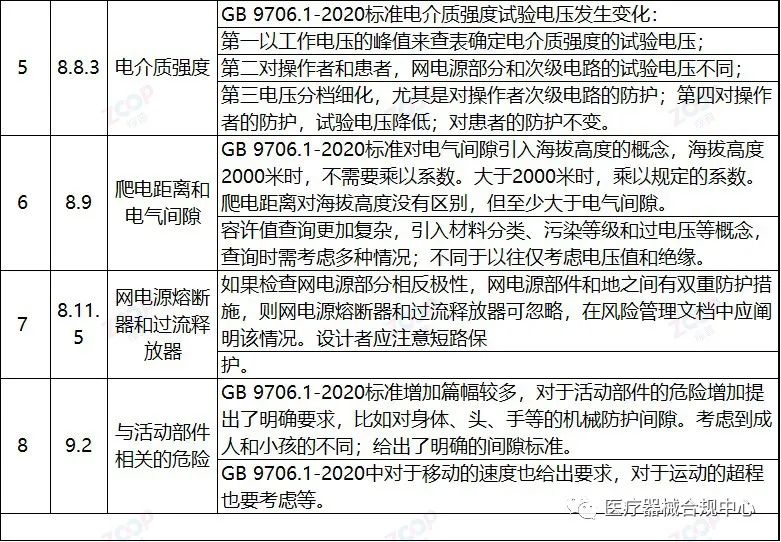
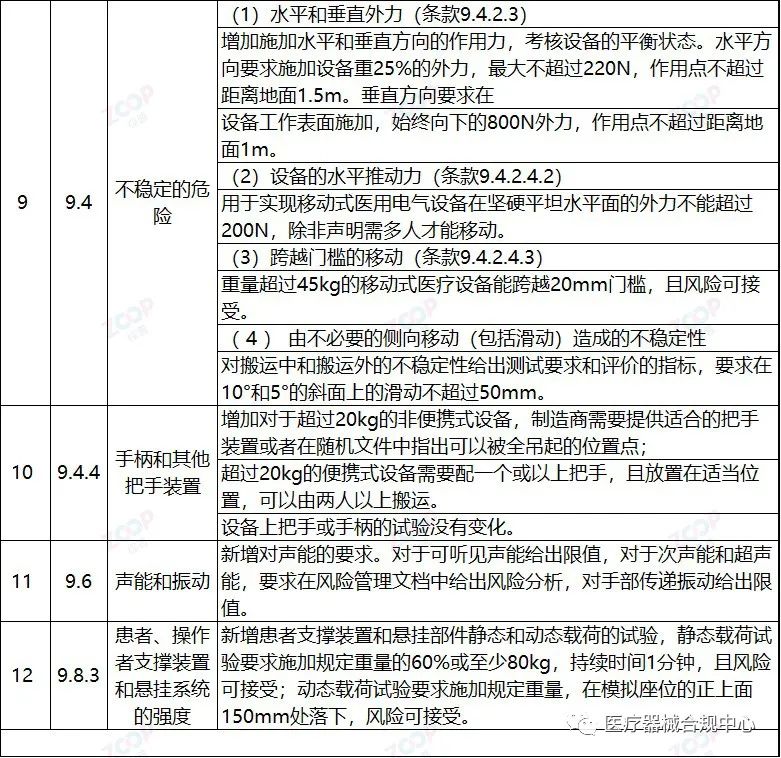
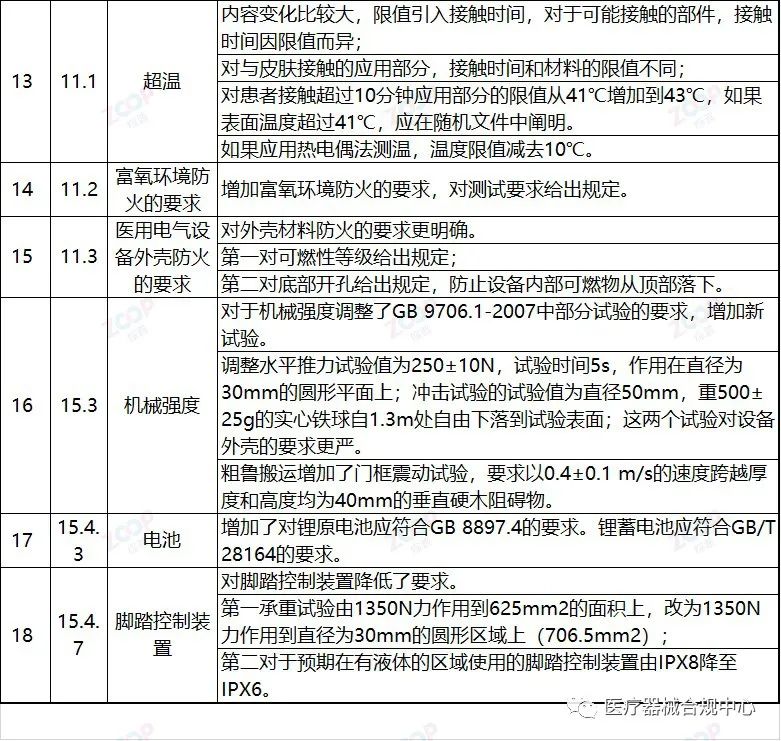
重点变化解析
Highlights Explanation of changes
综上所述,建议注册人根据产品注册证有效期、检验工作预期完成情况等,适时申请首次注册或延续注册等申报工作。