产品合规
备案/注册/咨询/培训
广东省药品监督管理局关于医疗器械生产监管系统正式上线的通告 为进一步落实新版《医疗器械监督管理条例》《医疗器械生产监督管理办法》要求,深化“互联网+监管”工作,提升监管效能,广东省“智慧药监”医疗器械生产监管系统已完成系统建设和测试,正式版将于6月10日正式上线。全省医疗器械注册人、备案人、受托生产企业可通过登录广东省智慧食药监企业专属网页(https://qy.gdfda.gov.cn/)-点击【数据报送】-【法人登录】-【医疗器械】菜单进行医疗器械生产品种信息上报、医疗器械企业报告信息(停产(复产)、重大事项改变)上报。 全省医疗器械注册人、备案人、受托生产企业应按照《医疗器械生产监督管理办法》有关要求,认真填写相关信息,上传相关材料,并对上报材料的合法、真实、准确、完整和可追溯负责。在系统使用过程中如遇系统操作和技术问题,可致电(020-37886123)或加入QQ群(719256878)进行咨询,相关政策问题可联系省药品监管局医疗器械监管处。
特此通告。 广东省药品监督管理局 2022年6月7日 |
附件一:医疗器械生产监管系统用户手册-企业端V1.0
(http://mpa.gd.gov.cn/zwfw/ywlcsm/ylqx/content/post_3945070.html 可查看 )
附件二:医疗器械生产监管系统常见问题解答V1.0
医疗器械生产监管系统
常见问题解答
(企业专属网页)
编制单位 数字广东网络建设有限公司
编制日期 2022年5月
1. 常见问题解答
1.1. 业务类型问题
1、批准日期、生效日期如何界定?
答:按照新注册管理办法取得的注册证,按照新版注册证上批准日期、生效日期填写;
按照旧注册管理办法取得的注册证,批准日期与生效日期相同。
2、“注册(备案)证”上传一栏中,是否需要上传注册(备案)证有效期内的变更文件?
答:暂不需要上传。
3、“产品技术要求”上传一栏中,是否需要上传产品技术要求的变更文件?
答:暂不需要上传。
4、是否只针对新版《医疗器械生产监督管理办法》实施后产品,还是也要求将《办法》实施前生产产品的信息进行上报,如包括实施前的产品信息,则“委托生产质量协议”上传一栏中,针对2022年5月1日以前已办理委托生产备案的产品,只有委托生产合同/协议,是上传《委托生产备案凭证》还是《委托生产合同/协议》,还是按照《医疗器械委托生产质量协议编制指南》要求,补充委托生产质量协议?
答:完成批准日期在2022年5月1日后的广东省内审批的第二类医疗器械产品信息以及所有广东省外的第二类医疗器械产品、第一类医疗器械产品、第三类医疗器械产品。批准日期在2022年5月1日前的广东省内审批的第二类医疗器械产品,系统后续通过同步许可系统的产品注册信息、企业核对并完善、补充上传相关附件完成填报。
生产方式为“委托生产”“受托生产”:需上传《委托生产质量协议》附件,不是《委托生产合同》。
1.2. CA证书问题
1.2.1. CA证书登录问题
1、已安装最新版本的CA助手、网政通客户端4.3.0.5版本,还是提示要下载最新版本的CA助手?
答:建议重新安装旧版CA助手。安装包可在所在QQ群的【群文件】中下载,或添加技术支持人员QQ:3378622150
2、 CA证书续费后,历史上报数据看不到了,怎么办?
答:CA证书续费后,证书缩略图会更新,在《CA证书改绑登记表》登记信息,等技术人员处理即可,CA改绑信息登记表:CA改绑信息登记表
3、 CA证书的企业名称与实际许可证企业名称不一致,导致历史上报数据看不到,怎么办?
答:需联系网政通技术人员,将CA证书上的企业名称修改成与许可证上的企业名称一致即可。
客户服务热线:400-830-1330
客户服务QQ:4008301330
网政通官网:广东省电子商务认证有限公司 (cnca.net)
4、使用数字证书登录,提示“该证书非本平台支持的证书,请使用本平台支持的证书“

或提示“验签失败”“签名失败”
确认是使用数字证书(CA证书)登录。如是,按以下步骤操作:
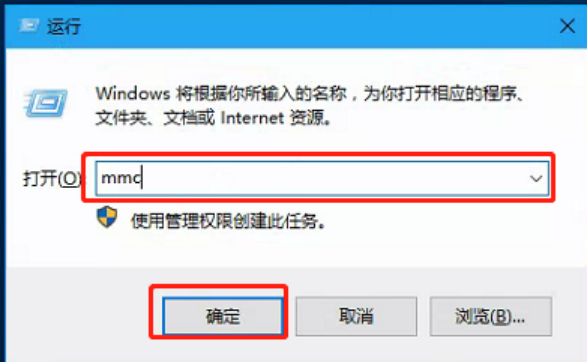
1)同时按 win+r 键,左下角出现运行窗口,输入mmc点击确认
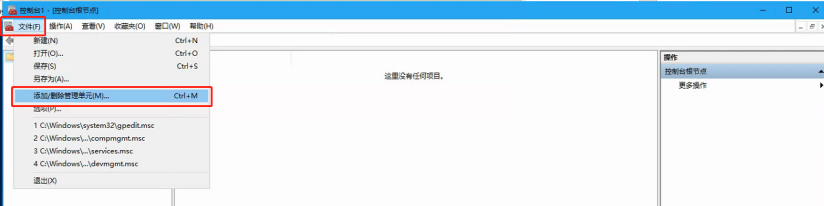
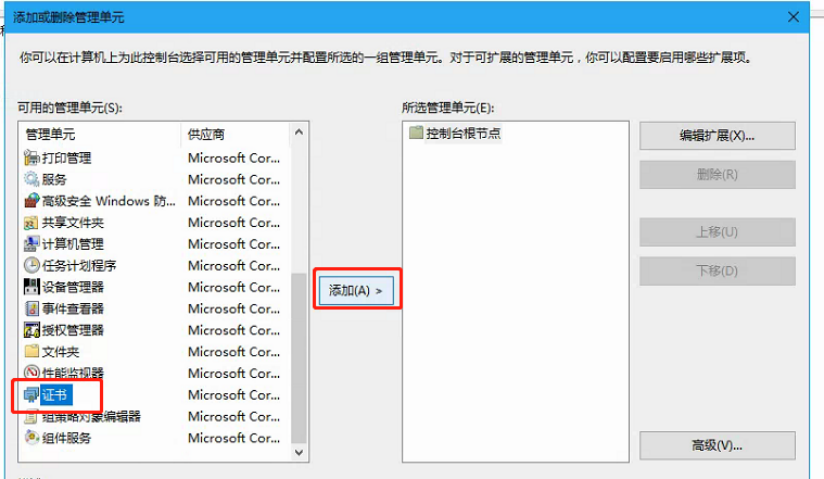
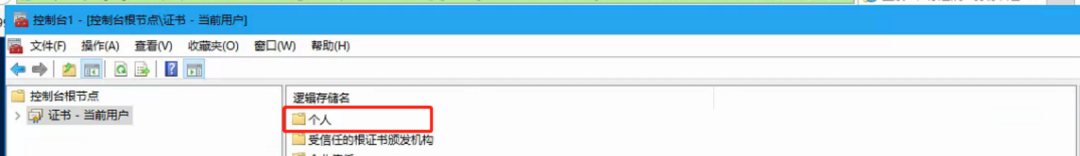
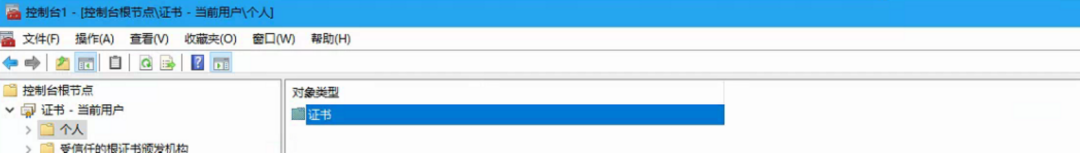
按以上步骤操作,全选证书,右键删除
重新插数字证书,刷新浏览器页面,进行登录。
1.2.2. 账号密码登录问题
1、如登录后提示“获取企业信息失败”,怎么办?

要使用法人账号(即:企业账号)登录。
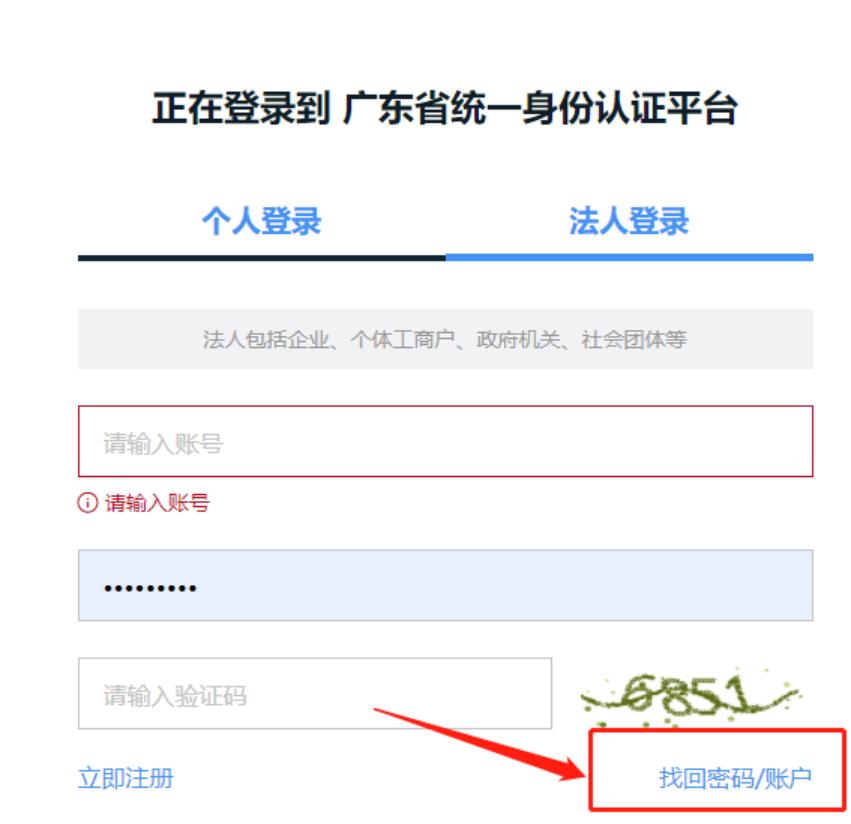
2、忘记密码怎么找回?
1.2.3. 省统一认证账号问题
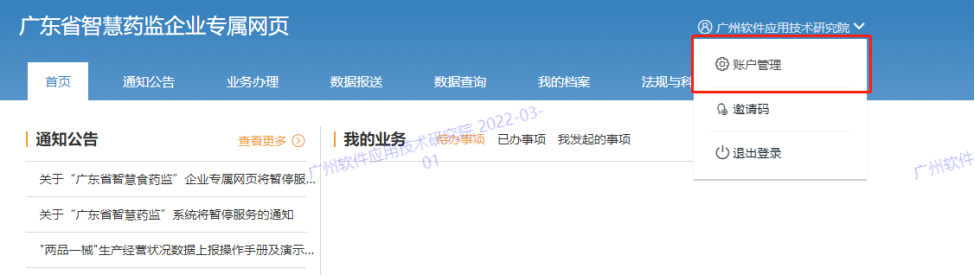
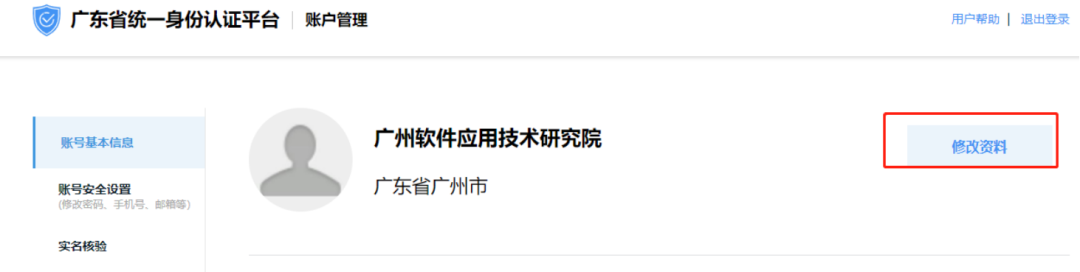
1、企业名称变更,如何修改省统一认证账号的企业名称?
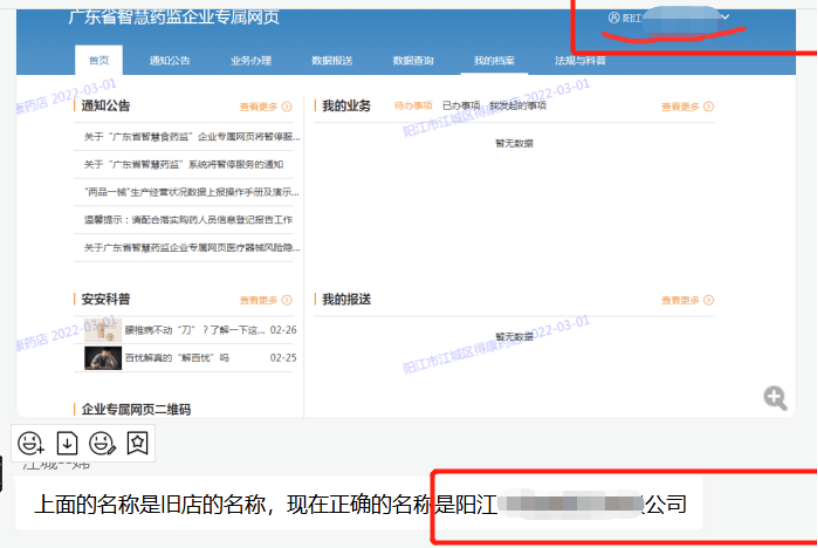
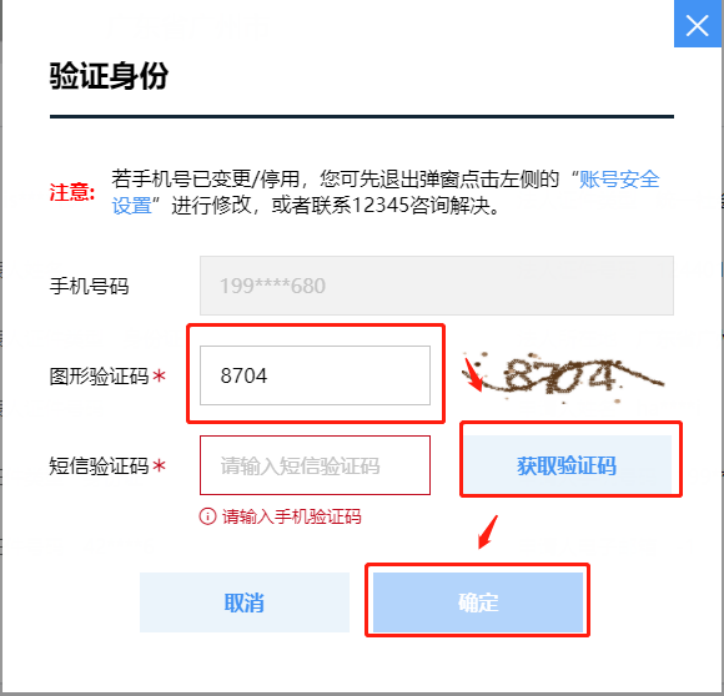
点击右上角的【企业名称】,选择【账户管理】-【修改资料】,填写图形验证码、短信验证码,点击【确定】,验证成功身份后进行企业名称修改。
1.3. 系统操作问题
1、产品信息填报页面,输入产品的注册证编号后,无法自动获取产品名称、批准日期、有效期至信息。
答:非系统功能问题,属于数据库数据不完善,除广东省内审批的第二类医疗器械产品外,其余类型产品可由企业按照实际情况自行填报。
2、导入附件要点很多次,显示请求上传接口出现异常,等久一点或者多点几下可以上传。
答:当文件大小较大时,等待一下即可上传成功。
3、 批量上传的时候只能识别到最后一个产品,没办法识别到全部。
答:原导入模板的第二行是提示,不允许删除,系统默认从第三行开始判断导入。将第二行的提示删除后,所以第二行的产品没有识别导入。
4、上报广东省内审批的第二类产品时,提示“产品信息在系统数据库中搜索不到,请联系技术人员”,无法提交,如下:
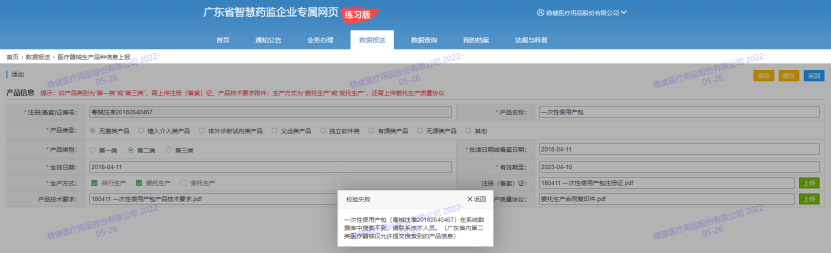
答:本省的第二类医疗器械产品(注册(备案)证编号开头含“粤”),如获取不到,提供产品注册证文件,反馈给咨询群(QQ群:719256878)技术人员处理。
5、填写产品信息、上传产品附件、点击提交时,提示“后台接口请求异常”,怎么办?
答:1、检查上传的附件是否超过20M,如是,压缩附件或换成图片格式后再上传;
2、清理浏览器缓存,重新登录上传;
3、更换成谷歌浏览器、360浏览器、微软edge浏览器再上传。